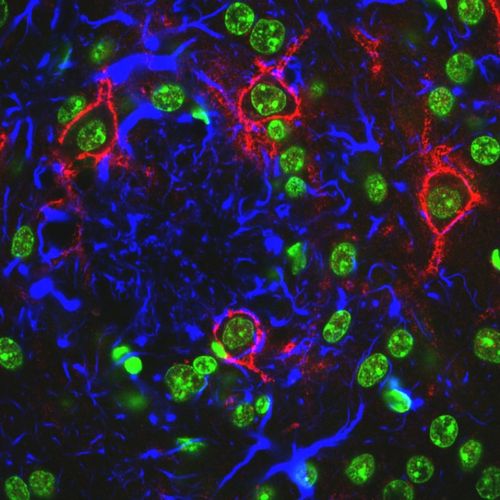
In dem aktuell gestarteten Forschungsprojekt untersucht er die Neuronen, die von einem perineuronalen Netz, einer Art Mantel oder Panzer umgeben sind, der die Zelle schützt. Zwar hat jede Zelle einen Mantel, aber das perineuronale Netz sei im Vergleich besonders dick und groß. „Noch dazu ist es negativ geladen. Man spricht von einem ‚Ladungsschild‘ um die Zelle herum, das sie von außen unangreifbarer macht“, erklärt der Leipziger Forscher. Unangreifbar auch gegenüber sogenannten Tau-Protein-Ablagerungen, die sich bei Alzheimer-Patienten in den Nervenzellen bilden und so vermutlich zum Nervenzelluntergang beitragen?
Experimente im Reagenzglas und im Tiermodell
Um das herauszufinden, hat Morawski mit seinem Team Neuronen-Kulturen angelegt. In diesen Versuchen zeigt sich bereits der positive Effekt des perineuronalen Netzes um die Zelle herum. Nun müssen die Wissenschaftler noch herausfinden, ob sich die Ergebnisse auch in einem aktiven Organismus reproduzieren lassen. Im Tiermodell reduzieren die Forscher eine Hauptkomponente der perineuronalen Netze, sodass die Zellen nicht mehr so gut geschützt sind. In einer Kreuzung mit Tieren, die übermäßig viele der schädlichen Tau-Proteine ablagern, wollen die Wissenschaftler herausfinden, ob wirklich der Mantel um die Nervenzelle herum den Ausschlag gibt. Das wäre dann ein neuer Ansatzpunkt für ein Therapeutikum. „Denkbar wäre, dass Patienten schon vor dem offensichtlichen Ausbruch der Alzheimerschen Krankheit ein Zucker-Molekül, das Teil des perineuronalen Netzwerks ist, gespritzt bekommen würden. Dieses Molekül mit negativer Ladung würde die positiv geladenen Tau-Proteine wie ein Schwamm aufsaugen. Über die Stoffwechselprozesse der Zelle würden diese dann abgebaut werden und könnten sich nicht mehr in der Nervenzelle ablagern“, sagt Morawski.
In einem weiterem Forschungsprojekt erstellt Morawski einen Atlas der Nervenbahnkreuzungen und Größen
Um bei der Alzheimerschen Erkrankung schon möglichst früh die kleinsten Plaque-Ablagerungen, etwa durch die Tau-Proteine feststellen zu können, greift man in der Diagnostik auf die Magnetresonanztherapie, kurz MRT, zurück. Allerdings ergibt sich bei der Auswertung von MRT-Bildern oft ein Problem: Die Geräte können die Nervenbahnen und Kreuzungen im Gehirn nur im Millimeter Bereich auflösen, Top-Geräte etwa bis 0,5 Millimeter. Die einzelnen Nervenfasern bewegen sich jedoch im Mikrometer-Bereich. Das heißt: Das MRT kann die Nervenfasern und ihre Verlaufsrichtung nur grob darstellen.
Zusammen mit Wissenschaftlern des Max-Planck-Instituts für Kognitions- und Neurowissenschaften und des Universitätsklinikums Hamburg-Eppendorf überprüft Markus Morawski in dem DFG-geförderten Forschungsprojekt die Größe und den Verlauf der Nervenbahnen auf Mikroebene. Dazu untersucht er kleine Blöcke des menschlichen Gehirns, macht sie mittels eines in Leipzig entwickelten Verfahrens durchsichtig und kartiert die einzelnen Fasern mithilfe eines 3D- und Elektronen-Mikrokops. Diese Daten münden in eine Art „Altas der Nervenbahnkreuzungen und Größen“. Die histologischen Informationen werden dann zurückgespielt und sollen künftig helfen, die Modellierung von MRT-Daten zu verbessern. Die Interpretation von MRT-Bildern wird mit diesen zusätzlichen Informationen verbessert und erleichtert die Diagnostik und Therapie. Das sei besonders für neurodegenerative Erkrankungen maßgeblich, so Morawski. „Bei Parkinson können wir dann beispielsweise ganz genau sehen, wie viel Substanz der betreffenden Hirnregion schon degeneriert ist. Ablagerungen im Gehirn bei Alzheimer könnten wir schon im Frühstadium detektieren und so auch schneller gegensteuern.“ Dieses Teilprojekt im Rahmen des DFG-Schwerpunktprogramm 2041 „Computational Connectomics“ läuft noch bis 2021und ist mit rund 600.000 Euro gefördert.
Fachveröffentlichung in Neuroimage:
“Developing 3D microscopy with CLARITY on human brain tissue: Towards a tool for informing and validating MRI-based histology”, DOI: 10.1016/j.neuroimage