Etwa 40 Prozent aller Medikamente wirken auf G-Protein-gekoppelte Rezeptoren (GPCRs) und erreichen damit eine Linderung oder gar Heilung einer Vielzahl von Erkrankungen. Dazu zählen Wirkstoffe zur Therapie von Morbus Parkinson, Schmerzen, Bluthochdruck oder Allergien. GPCRs sind für die Wirkstoffe gut zu erreichen, weil sie auf Zelloberflächen sitzen. Zudem besitzen jede Zelle des Körpers und seine Organe sehr spezifische GPCR-Muster, wodurch die Nebenwirkungen durch GPCR-Wirkstoffe gut begrenzt werden können. „Eine große Familie innerhalb der über 700 Mitglieder zählenden GPCR-Klasse, die Adhäsions-GPCRs (aGPCRs), sind jedoch noch pharmakologisches und pharmazeutisches Neuland. Dabei werden mit diesen Molekülen sehr viele Krankheiten, von Krebs bis hin zu psychiatrischen Störungen, in Verbindung gebracht“, erklärt Dr. Nicole Scholz, Arbeitsgruppenleiterin am Lehrstuhl für Allgemeine Biochemie des Rudolf-Schönheimer-Instituts und eine der beiden Leiterinnen der aktuellen Studie.
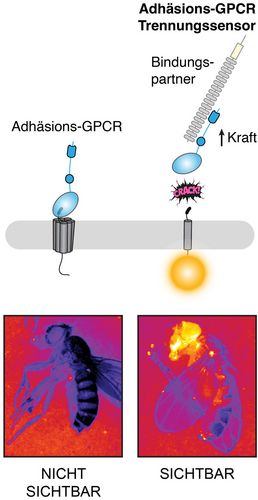
Adhäsions-GPCRs bilden eine große Klasse von Oberflächenproteinen, die im Körper chemische und mechanische Reize erkennen. Sie sind für therapeutische Wirkstoffe noch ungenutzt. aGPCRs verfügen über eine Zwei-Komponenten-Struktur und einen außergewöhnlichen Aktivierungsmechansimus. Die Leipziger Wissenschaftler:innen haben nun ein molekulares Sensorsystem vorgestellt, mit dem man in lebenden Organismen und in der Zellkulturschale erkennen kann, wann und wo ein aGPCR durch mechanische Reizung auseinanderbricht und dass dadurch die beiden Komponenten getrennt werden. Der Bruch kann die Rezeptoren aktivieren und hat damit eine entscheidende Bedeutung für die Weitergabe des biochemischen Signals. Diese Technologie haben Dr. Scholz und Prof. Dr. Tobias Langenhan in enger Zusammenarbeit mit der Abteilung für Wissens- und Technologietransfer der Universität Leipzig zum Patent angemeldet. Es soll die neuen Ergebnisse rechtlich schützen und helfen, die nun möglichen Verfahren zur aGPCR-Wirkstoffidentifizierung zur Anwendungsreife zu bringen.
Wichtiger biologischer Prozess
„Es gibt die Vorstellung, dass viele aGPCRs wie Handgranaten aktiviert werden. Die beiden Teile des aGPCRs entsprechen dem Sicherungsstift und der Sprengladung. Wenn der Sicherungsstift durch mechanische Reize und Bindungsmoleküle des Rezeptors abgezogen wird, ist die Sprengladung in Form der Rezeptoraktivität scharf geschaltet. Wir können durch unsere Arbeit nun ein Verfahren anbieten, mit dem man diesen Mechanismus sichtbar machen kann. Insbesondere konnten wir zeigen, in welchen Zellen es zur Rezeptortrennung kommt und unter welchen Bedingungen sie stattfindet“, sagt Tobias Langenhan, Professor für Allgemeine Biochemie am Rudolf-Schönheimer-Institut, der zusammen mit Dr. Nicole Scholz die Studie leitet.
Dr. Scholz fügt hinzu: „Uns ist es gelungen, einen wichtigen biologischen Prozess einer großen Rezeptorfamilie im lebenden Tier, der Taufliege, sichtbar zu machen. Zukünftige Projekte werden sich unter anderem damit befassen, diese Erkenntnisse auf menschliche aGPCRs zu übertragen. Im besten Fall werden wir langfristig in der Lage sein, Wirkstoffe zu finden, die die Aktivität dieser Rezeptoren modulieren, und Medikamente entwickeln, die Symptome von Adhäsions-GPCR-bedingten Krankheiten bekämpfen können.“
Genau für dieses Vorhaben haben die Erfinder:innen nun vom Bundesministerium für Bildung und Forschung eine Förderempfehlung erhalten und können die aktuellen Ergebnisse vertiefen und das Verfahren unter anderem für eine unternehmerische Nutzung validieren. „Der Standort Leipzig ist für die Entwicklung des NRS-Verfahrens von großer Bedeutung gewesen. Er bündelt momentan weltweit wohl die meisten Arbeitsgruppen, die an Adhäsions-GPCRs forschen, und bietet damit ein kritisches wissenschaftliches Umfeld“, sagt Prof. Langenhan.
Originalpublikation in Nature: Molecular sensing of mechano- and ligand-dependent adhesion GPCR dissociation. DOI: 10.1038/s41586-023-05802-5
Wichtige Beiträge zu dieser Publikation hat die Forschungsgruppe FOR 2149 „Adhesion GPCR Signaling" geleistet, die von 2015-2022 bestand. Die aktuelle Arbeit wurde außerdem durch den Sonderforschungsbereich 1423 der Universität Leipzig „Strukturelle Dynamik der GPCR-Aktivierung und Signaltransduktion“ unterstützt.