Das Team um Dr. Chen Song aus dem Arbeitskreis von Prof. Dr. Jörg Matysik vom Institut für Analytische Chemie an der Universität Leipzig hat einen neuartigen Ansatz zur Probenvorbereitung für Festkörper-NMR-Untersuchungen des enzymatischen PET-Abbaus entwickelt. Dabei wurde das polyesterspaltende Enzym TfCut2 zusammen mit dem Substrat PET in eine glasartige Matrix eingebettet. „Für unsere Studie haben wir zudem kurzkettiges (fachsprachlich: oligomeres) 13C-isotopenmarkiertes PET verwendet, das wir, da es kommerziell nicht erhältlich ist, in Zusammenarbeit mit dem Arbeitskreis um Prof. Dr. Michael Sommer von der TU Chemnitz synthetisiert haben. Der Einsatz des oligomeren PET-Substrats ist besonders, da in vorherigen Studien (aufgrund praktischer Schwierigkeiten) nur kleine, lösliche und nicht-hydrolisierbare Modell-Substrate verwendet wurden, welche die Eigenschaften einer langen PET-Polymerkette kaum repräsentieren können“, sagt Patricia Falkenstein aus dem Arbeitskreis von Prof. Matysik.
Falkenstein konnte so den enzymatischen PET-Hydrolyseprozess mithilfe zeitaufgelöster Festkörper-NMR-Daten in Echtzeit verfolgen und PET-Kettendynamiken untersuchen. In Kombination mit neuartigen Molekulardynamik (MD)-Simulationen, die vom Kooperationspartner am Institute of Marine Sciences in Barcelona durchgeführt wurden, konnten außerdem spezifische Enzym-Substrat-Wechselwirkungen während des Abbauprozesses identifiziert werden.
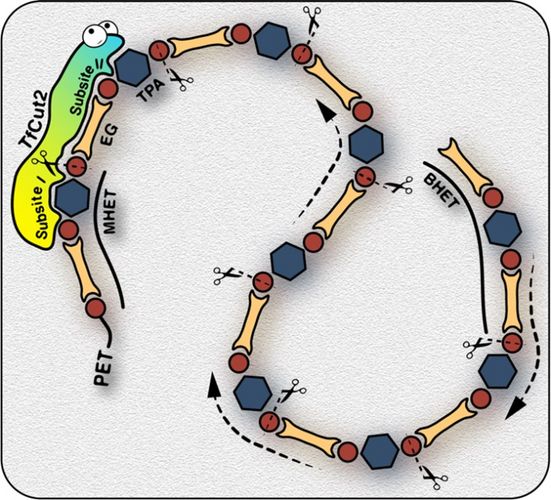
Mithilfe dieser experimentellen Daten konnte schließlich ein Mechanismus für den enzymatischen PET-Abbau abgeleitet werden: Die polymere PET-Kette wird durch das Enzym TfCut2 zunächst in kleinere Einheiten gespalten, die mindestens aus einer Wiederholeinheit (Monohydroxyethylterephthalat, MHET) bestehen. Diese werden in einem zweiten Schritt weiter in die Endprodukte Terephthalsäure (TPA) und Ethylenglykol (EG) gespalten. Dabei ist während des Abbauprozesses nur eine PET-Wiederholeinheit an das Enzym gebunden, während der Rest der PET-Kette nur lose an das aktive Zentrum gebunden ist. Die sogenannte „Subsite II“ (Bindungsstelle II) des Enzyms unterstützt stattdessen das Gleiten der PET-Kette in das aktive Zentrum, so dass ein schrittweiser Abbau des polymeren Substrats an der „Subsite I“ (Bindungsstelle I) ermöglicht wird.
„Diese Ergebnisse widersprechen der früheren Annahme, dass die PET-Kette während des enzymatischen Abbauprozesses mit mehreren Wiederholeinheiten an das Enzym gebunden ist. Der ursprüngliche Vorschlag basierte jedoch in erster Linie auf molekularen Docking-Studien, die möglicherweise die Flexibilität der PET-Kette am aktiven Zentrum des Enzyms nicht ausreichend gut widerspiegeln. Insgesamt ermöglichen unsere Ergebnisse ein neues Verständnis des biokatalytischen PET-Abbaumechanismus von Polyesterhydrolasen“, schätzt Prof. Dr. Jörg Matysik ein. Außerdem berge die Arbeit interessante Ansätze für die Entwicklung von PET-abbauenden Enzymen mit verbesserter Aktivität und Thermostabilität mittels rationalem Proteindesign. „Wir gehen davon aus, dass der in dieser Studie verfolgte Ansatz den Weg für die Untersuchung der Struktur-Funktions-Beziehungen anderer Enzyme mit wesentlich höherer PET-hydrolysierender Aktivität ebnet“, so Matysik.
Originaltitel der Veröffentlichung in “ACS Catalysis“:
"On the binding mode and molecular mechanism of enzymatic polyethylene terephthalate degradation", doi: 10.1021/acscatal.3c00259