Die Multiple Sklerose (MS) ist eine schwerwiegende neurologische Erkrankung mit zumeist bleibender Behinderung. Weltweit sind etwa 2,9 Millionen Menschen betroffen, 240.000 allein in Deutschland. Die genaue Ursache der Erkrankung ist bisher nicht geklärt, aber ein zentrales Merkmal ist ein durch Autoimmunprozesse ausgelöster Verlust der isolierenden Schutzschicht von Axonen, den neuronalen Verbindungen im zentralen Nervensystem. Die als Myelin bezeichnete Umhüllung der Axone wird durch hochspezialisierte Gliazellen, die Oligodendrozyten, ausgebildet und ermöglicht die schnelle Weiterleitung elektrischer Nervenimpulse. Bisher geht man bei der MS davon aus, dass Oligodendrozyten und Myelin durch Immunzellen abgebaut werden, und die dann schutzlosen Axone aufgrund weiterer lokaler Entzündungsprozesse irreversible Schäden davontragen. Der Verlust von Axonen spielt letztlich eine entscheidende Rolle für die Erkrankungsschwere von Patient:innen und den Verlauf der MS.
Aktuelle Forschungsergebnisse eines Teams aus Wissenschaftler:innen der Universität Leipzig und des Max-Planck-Instituts für multidisziplinäre Naturwissenschaften in Göttingen deuten nun darauf hin, dass sich das Verständnis der Krankheit an dieser Stelle ändern muss. In der aktuellen Studie konnten die Forschungsgruppen zeigen, dass das bisher als schützend angesehene Myelin, das Überleben der Axone sogar gefährden kann. Das ist zum Beispiel der Fall, wenn Myelinscheiden durch Immunzellen angegriffen wurden, aber weiterhin die Axone umhüllen und damit von der Außenwelt isolieren. Oligodendrozyten sind nämlich nicht nur für die Bildung des Myelins zuständig. Sie leisten auch wichtige Unterstützungsfunktionen für den Energiestoffwechsel der Axone. Insbesondere myelinisierte Axone sind stark von metabolischer Unterstützung abhängig, da sie kaum eigenen Zugang zu Nährstoffen haben. Für die Unterstützung myelinisierter Axone durch eine Myelinscheide hindurch ist es erforderlich, dass die Architektur des Myelins intakt ist, einschließlich der engen Kommunikationskanäle zwischen Oligodendrozyten und Axonen.
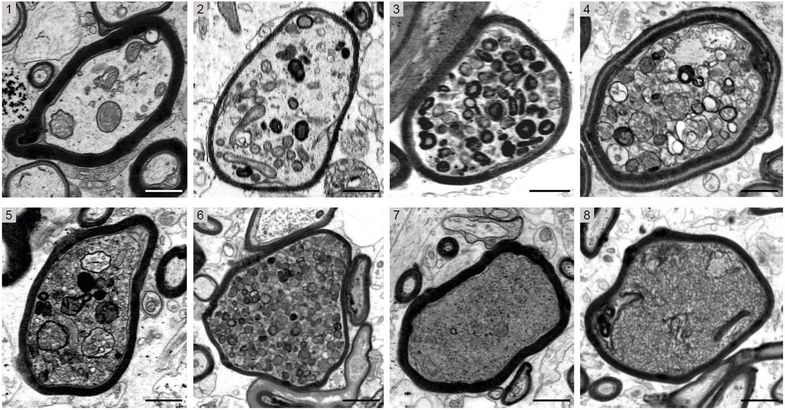
Gewebeproben mit Elektronenmikroskopie untersucht
„Wenn Oligodendrozyten einer akuten entzündlichen Umgebung ausgesetzt sind, könnten sie ihre unterstützende Funktion für die Nervenfasern verlieren und das Myelin wird zu einer Bedrohung für das Überleben der Nervenfasern“, beschreibt Prof. Klaus-Armin Nave vom Max-Planck-Institut für multidisziplinäre Naturwissenschaften in Göttingen die eingangs aufgestellte Forschungshypothese des Teams. Um ihre Vermutung zu überprüfen, untersuchten die Forschenden Gewebeproben von Patient:innen mit Multipler Sklerose und zusätzlich verschiedene Mausmodelle dieser Krankheit, um den Autoimmunangriff auf das Myelin experimentell nachzustellen. Dabei konnten sie erstmals in den Gewebeproben der Erkrankten mit Elektronenmikroskopie nachweisen, dass die irreversible Schädigung fast immer in den noch mit Myelin ummantelten Axonen auftritt (s. Abbildung). Umgekehrt konnten die Wissenschaftler:innen mit Hilfe von genetisch veränderten Mausmodellen zeigen, dass „nackte“ Axone in einer akuten entzündlichen Region des zentralen Nervensystems besser vor der Degeneration geschützt sind.
„Indem wir das vorherrschende Bild von Myelin als ausschließlich schützende Struktur hinterfragen, können wir ein tieferes Verständnis der Krankheit gewinnen und möglicherweise neue therapeutische Strategien entwickeln, um die Funktionalität der Nervenfasern zu bewahren", erklärt Prof. Ruth Stassart, Paul-Flechsig-Institut – Zentrum für Neuropathologie und Hirnforschung, Institut für Neuropathologie am Universitätsklinikum Leipzig. „Anstatt das geschädigte Myelin zu erhalten könnte es therapeutisch sogar besser sein, den schnellen Abbau zu fördern und die Neubildung von funktionsfähigem Myelin zu unterstützen“, ergänzt Dr. Robert Fledrich, Wissenschaftler am Institut für Anatomie der Universität Leipzig.
Originalpublikation in Nature Neuroscience:
"Myelin insulation as a risk factor for axonal degeneration in autoimmune demyelinating disease", Doi: 10.1038/s41593-023-01366-9